یک نوع ژن انسانی از آسیبهای مربوط به فشار خون مصون هستند
به گزارش گروه دانش و فناوری خبرگزاری آنا به نقل از وبگاه (سای تک دیلی)، با کمال تعجب، بیماران خاصی با ژن PDE۳A جهش یافته از آسیبهای مربوط به فشار خون بالا مصون بودند.
دانشمندان در برلین چندین دهه در حال مطالعه یک بیماری ارثی عجیب هستند که باعث میشود نیمی از افراد در خانوادههای خاص انگشتان به طرز تکان دهندهای کوتاه و فشار خون غیرعادی بالا داشته باشند.
اگر درمان نشود، افراد مبتلا اغلب در سن ۵۰ سالگی بر اثر سکته مغزی میمیرند. محققان مرکز ماکس دلبروک (MDC) در برلین منشاء این بیماری را در سال ۲۰۱۵ کشف کردند و توانستند پنج سال بعد با استفاده از مدلهای حیوانی آن را تأیید کنند: یک جهش. در ژن فسفودی استراز ۳A (PDE۳A) باعث میشود آنزیم رمزگذاری شده آن بیش از حد فعال شود، رشد استخوان را تغییر داده و باعث هیپرپلازی عروق خونی و در نتیجه فشار خون بالا میشود.
در برابر آسیبهای مربوط به فشار خون بالا مصون است
دکتر Enno Klußmann، رئیس آزمایشگاه سیگنالینگ لنگر در مرکز Max Delbrück و دانشمند مرکز آلمان برای تحقیقات قلب و عروق (DZHK) میگوید: فشار خون بالا تقریباً همیشه منجر به ضعیف شدن قلب میشود.
کلوسمان توضیح میدهد که از آنجایی که باید در برابر فشار بالاتر پمپاژ کند، اندام سعی میکند بطن چپ خود را تقویت کند. اما در نهایت، این منجر به ضخیم شدن عضله قلب - معروف به هیپرتروفی قلب - میشود که میتواند منجر به نارسایی قلبی شود و ظرفیت پمپاژ آن را تا حد زیادی کاهش دهد.
با این حال، این در بیماران فشار خون بالا با انگشتان کوتاه و ژنهای جهش یافته PDE۳A اتفاق نمیافتد.
کلوسمان میگوید: به دلایلی که اکنون تا حدی هنوز کاملاً شناخته نشدهاند، به نظر میرسد که قلب آنها از آسیبهایی که معمولاً از فشار خون بالا ناشی میشود مصون است.
این تحقیق توسط دانشمندان مرکز Max Delbrück، Charité – Universitätsmedizin Berlin و DZHK انجام شده و در مجله Circulation منتشر شده است.
این تیم که شامل ۴۳ محقق دیگر از برلین، بوخوم، هایدلبرگ، کاسل، لیمبورگ، لوبک، کانادا و نیوزلند بود، اخیراً یافتههای خود را در مورد اثرات محافظتی جهش ژنی منتشر کرده است - و اینکه چرا این اکتشافات ممکن است راه قلب را تغییر دهد. شکست در آینده درمان میشود. این مطالعه دارای چهار نویسنده اول است که سه نفر از آنها محقق مرکز ماکس دلبروک و یک نفر در ECRC هستند.
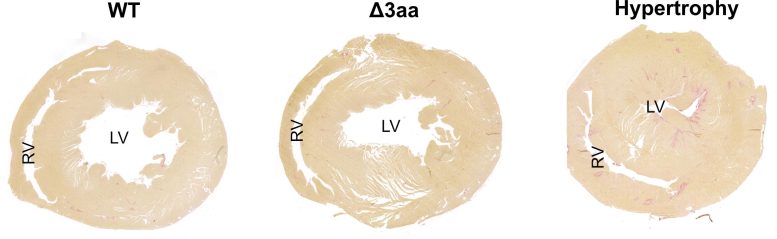
مقطع از طریق قلب طبیعی (چپ)، از طریق یکی از قلبهای جهش یافته (مرکز)، و از طریق یک قلب شدید هیپرتروفیک (راست). در دومی، بطن چپ بزرگ شده است.
دو جهش با اثر یکسان
دانشمندان آزمایشات خود را بر روی بیماران انسانی مبتلا به فشار خون بالا و سندرم براکیداکتیلی (HTNB) - یعنی فشار خون بالا و انگشتان کوتاه غیر طبیعی - و همچنین روی مدلهای موش و سلولهای عضلانی قلب انجام دادند. سلولها از سلولهای بنیادی مهندسی شده بهویژه به نام سلولهای بنیادی پرتوان القایی رشد کردند. قبل از شروع آزمایش، محققان ژن PDE۳A را در سلولها و حیوانات تغییر دادند تا جهشهای HTNB را تقلید کنند.
بهرینگ گزارش میدهد: ما در بیمارانی که بررسی کردیم با یک جهش ژن PDE۳A که قبلاً ناشناخته بود مواجه شدیم. مطالعات قبلی همیشه نشان داده بود که جهش در آنزیم خارج از حوزه کاتالیزوری قرار دارد -، اما ما اکنون یک جهش را درست در مرکز این دامنه پیدا کرده ایم. با کمال تعجب، هر دو جهش اثر یکسانی دارند، زیرا آنزیم را فعالتر از حد معمول میکنند. این بیش فعالی، تخریب یکی از مولکولهای مهم سیگنالی سلول به نام cAMP (آدنوزین مونوفسفات حلقوی) را که در انقباض سلولهای عضله قلب نقش دارد، افزایش میدهد.
Bähring مشکوک است: این امکان وجود دارد که این اصلاح ژن - صرف نظر از مکان آن - باعث شود دو یا چند مولکول PDE۳A در کنار هم قرار گیرند و بنابراین مؤثرتر عمل کنند.
پروتئینها ثابت میمانند
محققان از یک مدل موش استفاده کردند که با فناوری CRISPR-Cas۹ توسط آزمایشگاه مایکل بادر در مرکز Max Delbrück ایجاد شده است تا سعی کنند اثرات جهشها را بهتر درک کنند. Klußmann میگوید: ما حیوانات را با عامل ایزوپروترنول درمان کردیم، به اصطلاح آگونیست گیرنده بتا.
گاهی اوقات از چنین داروهایی در بیماران مبتلا به نارسایی قلبی در مرحله نهایی استفاده میشود. ایزوپروترنول به عنوان القای هیپرتروفی قلبی شناخته شده است. با این حال به طرز شگفت انگیزی، این اتفاق در موشهای اصلاح شده ژنی به شیوهای مشابه آنچه در حیوانات نوع وحشی مشاهده کردیم، رخ داد. بر خلاف آنچه ما انتظار داشتیم، فشار خون بالا وضعیت را تشدید نکرد. قلب آنها به وضوح از این اثر ایزوپروترنول محافظت شده بود.
در آزمایشهای بیشتر، این تیم بررسی کردند که آیا پروتئینها در یک آبشار سیگنالینگ خاص از سلولهای عضله قلب در نتیجه جهش تغییر میکنند و اگر چنین است، کدام یک از آنها تغییر میکند. از طریق این زنجیره از واکنشهای شیمیایی، قلب به آدرنالین پاسخ میدهد و در پاسخ به موقعیتهایی مانند هیجان سریعتر میتپد.
آدرنالین گیرندههای بتا سلولها را فعال میکند و باعث میشود که cAMP بیشتری تولید کنند. PDE۳A و سایر PDEها با تغییر شیمیایی cAMP این فرآیند را متوقف میکنند. Klußmann میگوید: با این حال، ما تفاوت کمی بین موشهای جهش یافته و نوع وحشی در هر دو سطح پروتئین و RNA پیدا کردیم.
کلسیم بیشتر در سیتوزول
تبدیل cAMP توسط PDE۳A فقط در هر جایی از سلول عضله قلب اتفاق نمیافتد، بلکه در نزدیکی یک سیستم غشایی لولهای که یونهای کلسیم را ذخیره میکند، رخ میدهد. انتشار این یونها در سیتوزول سلول باعث انقباض عضلانی میشود و در نتیجه باعث ایجاد ضربان قلب میشود. پس از انقباض، کلسیم توسط یک مجتمع پروتئینی به انبار بازگردانده میشود. این فرآیند نیز به صورت محلی توسط PDE تنظیم میشود.
Klußmann و تیم او این فرضیه را مطرح کردند که از آنجایی که این آنزیمها در ناحیه محلی اطراف پمپ کلسیم بیش فعال هستند، باید cAMP کمتری وجود داشته باشد - که میتواند فعالیت پمپ را مهار کند.
دکتر ماریا ارکو، یکی از اعضای آزمایشگاه Klußmann و یکی از چهار نویسنده اول این مطالعه، میگوید: در سلولهای عضله قلب اصلاحشده ژن، ما در واقع نشان دادیم که یونهای کلسیم بیش از حد معمول در سیتوزول باقی میمانند. این میتواند نیروی انقباضی سلولها را افزایش دهد.
فعال کردن به جای بازدارندگی
Klußmann توضیح میدهد: مهارکنندههای PDE۳ در حال حاضر برای درمان نارسایی حاد قلبی برای افزایش سطح cAMP استفاده میشوند. درمان منظم با این داروها به سرعت قدرت عضله قلب را کاهش میدهد.
کلوسمان میگوید: یافتههای ما اکنون نشان میدهد که نه مهار PDE۳، بلکه - برعکس - فعالسازی انتخابی PDE۳A ممکن است یک رویکرد جدید و بسیار بهبود یافته برای پیشگیری و درمان آسیبهای قلبی ناشی از فشار خون مانند کاردیومیوپاتی هیپرتروفیک و نارسایی قلبی باشد..
او میگوید، اما قبل از اینکه این اتفاق بیفتد، باید نور بیشتری بر روی اثرات محافظتی این جهش روشن شود. محقق گزارش میدهد: ما مشاهده کردهایم که PDE۳A نه تنها فعالتر میشود، بلکه غلظت آن در سلولهای عضله قلب کاهش مییابد و اضافه میکند که ممکن است بتوان اولی را با الیگومریزاسیون - مکانیزمی که حداقل دو آنزیم را شامل میشود - توضیح داد. مولکولها با هم کار میکنند.
کلوسمان میگوید: در این مورد، احتمالاً میتوانیم استراتژیهایی را توسعه دهیم که بهطور مصنوعی اولیگومریزاسیون موضعی را آغاز میکنند بنابراین اثر محافظتی برای قلب را تقلید میکنند.
انتهای پیام/