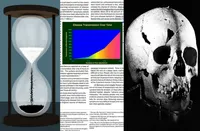
چگونه دارو مراحل آزمایش بالینی را طی میکند تا به درمان رایج تبدیل شود؟

خبرگزاری آنا- محمدامین پورحسینقلی: در دوران همهگیری کرونا، دو نام در عرصه داروها بیش از هر زمان دیگری شنیده شد: رمدسیویر و اینترفرون. این داروها که در اوج پاندمی امیدهایی برای درمان کرونا بودند، از طریق روند پیچیدهای به بیماران رسیدند. اما آیا تا به حال فکر کردهاید که چگونه یک دارو از مرحلهی آزمایشگاه به درمانهای روزمره پزشکی تبدیل میشود؟ فرآیند توسعه و تأیید یک دارو، یک مسیر طولانی و دقیق است که باید از فیلترهای متعددی بگذرد تا اطمینان حاصل شود که دارو هم ایمن است و هم مؤثر.
بیایید با هم نگاهی به این فرآیند علمی بیندازیم و ببینیم که داروهایی مانند رمدسیویر و اینترفرون چگونه به درمانهای پیشنهادی در دوران پاندمی تبدیل شدند.
مرحله اول: کشف دارو و تحقیقات پیشبالینی
فرآیند توسعه یک دارو معمولاً در آزمایشگاه شروع میشود. دانشمندان مولکولهایی را کشف میکنند که ممکن است در درمان یک بیماری مؤثر باشند. در این مرحله، تحقیقات اولیه بر روی سلولها و حیوانات انجام میشود تا اثرات اولیه دارو بررسی شود. این مرحله، که به آن مرحله پیشبالینی گفته میشود، معمولاً شامل آزمایشهای شیمیایی، بیوشیمیایی و حتی آزمایشهای حیوانی است.
توسعه یک دارو فرآیندی طولانی و پر از چالش است که بهدقت توسط دانشمندان و سازمانهای نظارتی بررسی میشود. این فرآیند تضمین میکند که دارویی که بهدست شما میرسد، هم ایمن است و هم مؤثر. از رمدسیویر تا اینترفرون، تمام داروهایی که در دوران پاندمی مورد استفاده قرار گرفتند، باید این مسیر را طی کنند تا بهعنوان درمانهای رسمی پذیرفته شوند.
بهعنوان مثال، در مورد رمدسیویر، این دارو ابتدا بهعنوان درمانی برای ویروس ابولا توسعه یافت، اما در آزمایشهای اولیه بر روی ویروسهای مرتبط با کرونا، نشان داده شد که میتواند اثرات مثبتی داشته باشد. در نتیجه، رمدسیویر وارد مرحله آزمایشهای بالینی شد.
مرحله دوم: آزمایشهای بالینی
پس از اینکه یک دارو از مرحله پیشبالینی عبور کرد و بهنظر رسید که در شرایط آزمایشگاهی و بر روی حیوانات ایمن و مؤثر است، وارد آزمایشهای بالینی میشود. این مرحله به چندین فاز تقسیم میشود:
فاز ۱: در این مرحله، دارو برای اولین بار بر روی تعداد کمی از افراد سالم آزمایش میشود تا ایمنی آن بررسی شود. این آزمایشها بهطور عمده بر روی بررسی عوارض جانبی دارو تمرکز دارند و بهدنبال یافتن دوزهای ایمن هستند.
فاز ۲: اگر دارو در فاز ۱ ایمن بود، به مرحله ۲ میرود. در اینجا، دارو بر روی تعداد بیشتری از بیماران آزمایش میشود تا اثربخشی آن بررسی شود. این مرحله معمولاً شامل چند صد نفر است و به دنبال پیدا کردن بهترین دوز دارو و بررسی عوارض جانبی آن است.
فاز ۳: در این مرحله، دارو بر روی تعداد بسیار بیشتری از بیماران (چندین هزار نفر) آزمایش میشود. هدف این فاز بررسی اثربخشی دارو در شرایط واقعی و مقایسه آن با درمانهای موجود یا دارونما (پلاسیبو) است. این مرحله کلیدی است، زیرا نتایج آن مشخص میکند که آیا دارو بهطور قطعی مؤثر است یا خیر.
در مورد رمدسیویر، این دارو در چندین کشور و در چندین فاز از آزمایشهای بالینی بر روی بیماران مبتلا به کرونا آزمایش شد تا مشخص شود که آیا واقعاً میتواند در کاهش مدت بستری شدن بیماران مؤثر باشد.

مرحله سوم: بررسی توسط سازمانهای نظارتی
بعد از اتمام آزمایشهای بالینی و کسب نتایج مثبت، دارو باید توسط سازمانهای نظارتی مانند سازمان غذا و دارو (کشورهای مختلف) تأیید شود. در این مرحله، تمام دادههای بهدستآمده از آزمایشهای بالینی به دقت بررسی میشود تا مطمئن شوند که دارو هم ایمن و هم مؤثر است.
در دوران پاندمی کرونا، برخی داروها مانند رمدسیویر به دلیل شرایط اضطراری با مجوز استفاده اضطراری وارد بازار شدند. این مجوز به داروهایی داده میشود که ممکن است در شرایط بحرانی مؤثر باشند، اما هنوز بهطور کامل مراحل آزمایشهای بالینی را طی نکردهاند. با این حال، این داروها همچنان تحت نظارت دقیق قرار دارند و در صورت مشاهده عوارض جانبی جدی، میتوانند از بازار خارج شوند.
مرحله چهارم: پایش پس از ورود به بازار
پس از تأیید و ورود دارو به بازار، فرآیند بررسی آن تمام نمیشود. حتی پس از تجویز دارو به بیماران، داروها تحت نظر قرار میگیرند تا هرگونه عوارض جانبی ناشناخته شناسایی شود. این مرحله بهعنوان پایش پس از بازار شناخته میشود و میتواند در برخی موارد منجر به اصلاح دوزها یا حتی جمعآوری دارو از بازار شود.
مثال: اینترفرون و پاندمی کرونا
اینترفرون یکی دیگر از داروهایی بود که در دوران پاندمی کرونا مورد بررسی قرار گرفت. اینترفرونها بهعنوان مولکولهای تنظیمکنندهی سیستم ایمنی شناخته میشوند و در درمان بیماریهای ویروسی مختلف استفاده شدهاند. در اوایل پاندمی، دانشمندان امیدوار بودند که اینترفرون بتواند در کاهش شدت کرونا مفید باشد، اما پس از انجام آزمایشهای بالینی مشخص شد که اثرات آن بهطور کلی محدود است.
چرا این فرآیند طولانی است؟
شاید برای برخی این سؤال پیش بیاید که چرا فرآیند توسعه و تأیید دارو اینقدر طولانی و پیچیده است؟ پاسخ ساده است: ایمنی و کارایی. داروهایی که وارد بازار میشوند باید از هر نظر ایمن باشند و عوارض جانبی آنها بهدقت بررسی شود. همچنین باید اطمینان حاصل شود که دارو واقعاً مؤثر است و فقط یک امید واهی نیست.
توسعه یک دارو فرآیندی طولانی و پر از چالش است که بهدقت توسط دانشمندان و سازمانهای نظارتی بررسی میشود. این فرآیند تضمین میکند که دارویی که بهدست شما میرسد، هم ایمن است و هم مؤثر. از رمدسیویر تا اینترفرون، تمام داروهایی که در دوران پاندمی مورد استفاده قرار گرفتند، باید این مسیر را طی کنند تا بهعنوان درمانهای رسمی پذیرفته شوند.
در نهایت، اعتماد به علم و روشهای دقیق آزمایشهای بالینی، بهترین راه برای تضمین سلامتی و بهبود سریعتر از بیماریهاست. دفعه بعد که کسی به شما گفت: "چرا اینقدر طول میکشد که داروها تأیید بشوند؟ "، میتوانید با لبخند بگویید: "برای اینکه مطمئن باشیم آن دارو واقعاً کار میکند! "
انتهای پیام/