ساخت داروهای سرطان به چه نحوی است؟
به گزارش گروه دانش و فناوری خبرگزاری آنا به نقل از وبگاه (سای تک دیلی)، دانشمندان Scripps Research شناسایی کردهاند که چگونه ساختار پروتئین PI۳Kα در سلولهای سرطانی تغییر میکند و بینشی در مورد استراتژیهای بالقوه هدفگیری دارو ارائه میدهد.
درک ساختار پروتئینهایی که باعث رشد سرطانهای تهاجمی میشوند در طراحی داروهایی که میتوانند به طور موثر رشد آنها را مهار کنند، بسیار مهم است.
دانشمندان موسسه تحقیقاتی اسکریپس ساختار سه بعدی فسفوئینوزیتید ۳-کیناز آلفا (PI۳Kα)، پروتئینی که اغلب در سلولهای سرطانی جهش مییابد، در مجموعهای از سه مقاله منتشر شده در مجموعه مقالات آکادمی ملی علوم نشان دادهاند. علاوه بر این، تیم تحقیقاتی همچنین بینشی در مورد چگونگی تغییر این ساختار با جهشهای مرتبط با سرطان ارائه کرده است که میتواند فرصتهای جدیدی را برای داروهایی ایجاد کند که میتوانند به طور خاص نسخههای جهشیافته را هدف قرار دهند.
پیتر وگت، نویسنده ارشد، دکتر و پروفسور دپارتمان پزشکی مولکولی در پژوهش اسکریپس، میگوید: ما امیدواریم که این یافتههای ساختاری دقیق منجر به کشف داروهایی شود که بر سلولهای سرطانی تأثیر میگذارند، اما بر سلولهای سالم تأثیر نمیگذارند. "این به طور بالقوه میتواند عوارض جانبی مرتبط با داروهای فعلی PI۳Kα را از بین ببرد.
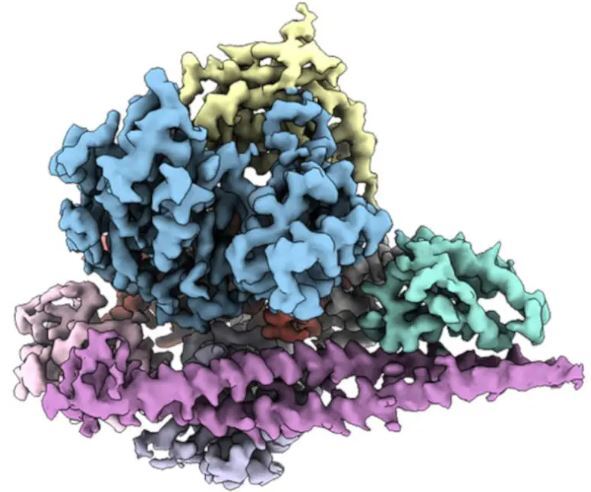
با تعیین ساختار سه بعدی PI۳Kα (نشان داده شده)، محققان اسکریپس راه را به سمت داروهایی هموار کردند که پروتئین را در سلولهای سرطانی هدف قرار میدهند. منبع: تحقیق اسکریپس
PI۳Kα نقش مرکزی در بقا و رشد سلول ایفا میکند. در سلولهای سالم، پروتئین در صورت نیاز روشن و خاموش میشود. اما در بسیاری از انواع سرطان - از جمله پستان، کولورکتال، آندومتر و مغز - جهش در PI۳Kα باعث میشود که همیشه فعال باشد و رشد کنترل نشده تومورها را تشویق میکند. داروهای فعلی که هدفشان ترمز کردن PI۳Kα است به بخشی از پروتئین متصل میشود که به ندرت بین نسخههای سالم و جهش یافته تغییر میکند. این بدان معنی است که تمام PI۳Kα در بدن خاموش است. به همین دلیل، این مهارکنندههای PI۳Kα دارای فهرست طولانی از عوارض جانبی و سمیت هستند.
Vogt میگوید: «برای حل این مشکل، باید بازدارندههایی بسازید که فقط نسخههای جهش یافته PI۳Kα را تشخیص دهند. اما برای انجام این کار، به اطلاعات ساختاری در مورد آنچه که PI۳Kα جهش یافته و بیش فعال را از PI۳Kα معمولی متمایز میکند، نیاز دارید.
این کار سادهای نیست: PI۳Kα یک پروتئین انعطافپذیر و «ویگیل» است، بنابراین گرفتن یک عکس فوری از ساختار آن دشوار است. با این حال، گروه Vogt متوجه شد که وقتی PI۳Kα به یکی از مهارکنندههای موجود متصل شد، پایدارتر شد. در مقالات PNAS منتشر شده در نوامبر ۲۰۲۱ و سپتامبر ۲۰۲۲، آنها از نوعی تکنیک تصویربرداری به نام میکروسکوپ الکترونی برودتی (cryo-EM) برای کار کردن ساختار سه بعدی PI۳Kα استفاده کردند. با این دانش، آنها ابتدا ساختار PI۳Kα متصل به بازدارنده را بررسی کردند. سپس، برای تجسم پروتئین بدون بازدارنده، از مولکولهای پیوند متقابل برای اتصال بخشهای مختلف PI۳Kα به خود استفاده کردند و انعطافپذیرترین بخشهای پروتئین را تثبیت کردند.
اخیراً، تیم تحقیقاتی از همان جعبه ابزار cryo-EM برای کنار هم قرار دادن ساختار دو نسخه جهش یافته PI۳Kα که اغلب در سلولهای سرطانی یافت میشود، استفاده کردند. آن کار که ماه گذشته در PNAS منتشر شد، نشان داد که چگونه برخی از بخشهای PI۳Kα جهش یافته شبیه شکل فعال شده PI۳Kα هستند.
وگت میگوید: تغییرات ساختاری کاملاً چشمگیری وجود دارد؛ و در پایان، تغییرات اساساً شکل طبیعی فعال شده پروتئین را تقلید میکنند، با تنها تفاوت این که همیشه در این ساختار فعال است.
یافتهها به راههایی برای استفاده از داروها برای خاموش کردن این نسخه همیشه روشن PI۳Kα در سلولهای سرطانی، بدون خاموش کردن PI۳Kα سالم اشاره دارد. وگت میگوید، نکته کلیدی این است که داروها باید به بخش متفاوتی از پروتئین PI۳Kα نسبت به جایی که مهارکنندههای PI۳Kα موجود متصل میشوند، متصل شوند - بخشی که از نظر ساختاری بین نسخههای سالم و جهشیافته پروتئین متفاوت است.
گروه آزمایشگاهی او این تحقیقات را با مطالعات بیشتری دنبال میکند که نشان میدهد چگونه داروهای فعلی ساختار PI۳Kα را تغییر میدهند.
انتهای پیام/
- تور استانبول
- غذای سازمانی
- خرید کارت پستال
- لوازم یدکی تویوتا قطعات تویوتا
- مشاوره حقوقی
- تبلیغات در گوگل
- بهترین کارگزاری بورس
- ثبت نام آمارکتس
- سایت رسمی خرید فالوور اینستاگرام همراه با تحویل سریع
- یخچال فریزر اسنوا
- گاوصندوق خانگی
- تاریخچه پلاک بیمه دات کام
- ملودی 98
- خرید سرور اختصاصی ایران
- بلیط قطار مشهد
- رزرو بلیط هواپیما
- ال بانک
- آهنگ جدید
- بهترین جراح بینی ترمیمی در تهران
- اهنگ جدید
- خرید قهوه
- اخبار بورس